Seit 2003 ernennt der Bundesverband Menschen für Tierrechte in Zusammenarbeit mit seinen Mitgliedsvereinen das „Versuchstier des Jahres“.
Der Fisch ist für die Forschung ein dankbares „Versuchstier“ – nicht umsonst rangiert er in der Tierversuchsstatistik an dritter Stelle. Er lässt sich schnell vermehren und eignet sich gut für gentechnische Manipulationen und Giftigkeitstests. Doch der Fisch ist keine Reflexmaschine. Als empfindsames Wirbeltier leidet er unter Schmerzen, Stress und Angst. Gemeinsam mit der Autorin und diesjährigen Schirmherrin Hilal Sezgin macht der Verband das Leid der Tiere im Labor öffentlich. Und er macht Druck für die Entwicklung tierversuchsfreier Verfahren – damit die qualvollen Tierversuche endlich aufhören.
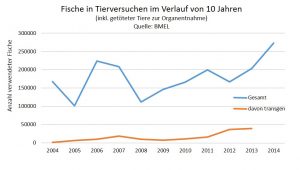
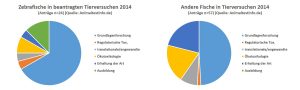
Fast 300.000 Fische im Tierversuch
In deutschen Tierversuchslaboren standen 2014 die Fische an dritter Stelle nach Mäusen und Ratten. Seit 2012 nehmen die Zahlen der in Tierversuchen eingesetzten Fischen rapide zu. Die letzte Steigerung erfolgte 2013/14 auf insgesamt 272.925 Fische. Das entspricht fast zehn Prozent (9,8) aller Tierversuche. Auch im langjährigen Verlauf nehmen die Zahlen zu – und dies, obwohl es mittlerweile im Bereich der Umwelttoxikologie ein anerkanntes Verfahren ohne ausgewachsene Fische gibt. Hintergrund für die Zunahme der Zahlen ist der rapide Anstieg von gentechnisch veränderten Fischen: Im Jahr 2013 waren 19,3 Prozent der Fische, die zu Forschungszwecken verwendet wurden, gentechnisch manipuliert. Allein für die Untersuchung der Auswirkung einer Manipulation wurde in 2014 der Einsatz von 297.000 Zebrafischen genehmigt. Damit rangieren die Fische bei den gentechnischen Veränderungen an zweiter Stelle nach den Mäusen.
Wird am häufigsten verwendet: der Zebrabärbling
Die in Tierversuchen verwendeten Fischarten sind vor allem der Zebrabärbling, aber auch Arten wie der Reiskärpfling oder Medaka, Forellen, Goldfische, Dorsche, Flussbarsche, Aale, Sprotten und Prachtgrundkärpflinge. Die Fische leiden hauptsächlich in der Grundlagenforschung, die sich mit humanmedizinischen Fragestellungen beschäftigt. Die Forschung nutzt Fische zudem, um Verfahren zur Manipulation des Genoms zu erforschen.
Für Untersuchungen mit dem Ziel einer erfolgreichen genetischen Manipulation waren 2014 84 Prozent der genehmigten Versuche an Zebrabärblingen vorgesehen. Diese Fischart wird u.a. genetisch verändert, um etwas über menschliche Erkrankungen herauszufinden (z. B. Entwicklung des Herzens und der Blutgefäße, der Knochenregeneration oder des Immunsystems. Bei den anderen Fischarten, wie Dorsch, Buntbarsch, Flussbarsch, Karpfen und Forelle, spielt ebenfalls vor allem die Grundlagenforschung eine Rolle (knapp 50 Prozent), aber auch Untersuchungen zur Umwelttoxikologie (20 Prozent), zur Erhaltung der Art (21 Prozent) zur Zucht, zur Haltung sowie zur Wiederansiedlung oder Wanderung. Die Forschungen zu Zucht- und Haltungsbedingungen für Fische im Rahmen der Lebensmittelerzeugung dienen vor allem dem Zweck, Fisch als Nahrungsmittel für den Menschen zu sichern. Dies ist wiederum mit großem Tierleid in der Intensivtierhaltung in Aquakulturen und der Tötung verbunden.
Zahl der gentechnischen Manipulationen steigt

Die Zahl der Tierversuche steigt im Bereich Gentechnik seit Jahren kontinuierlich an. Dies steht im Gegensatz zu den in Deutschland und der EU geltenden gesetzlichen Zielsetzungen, künftig weniger Versuchstiere für wissenschaftliche Zwecke einzusetzen. Steigende Tierversuchszahlen werden häufig durch kommerzielle Interessen verursacht. Maßgeschneiderte „Tierversuchsmodelle“ sind oft durch Patente geschützt, wie
z .B. Thrombosemodelle auf Basis gentechnischer Veränderungen des Zebrabärblings. In diesen Fällen sind nicht nur die fertigen „Modelle“ mit einem Patent belegt, sondern auch die Techniken zur Herstellung der „Modelle“. Die neuen Methoden der synthetischen Gentechnik führen zusätzlich dazu, dass immer mehr „Versuchstiere“ in immer kürzerer Zeit gentechnisch manipuliert werden können.
Fische leiden unter Schmerzen, Stress und Angst
Der vermeintlich stumme Fisch wird unterschätzt: Fische sind lernfähig, sie jagen koordiniert im Team, spielen, benutzen Werkzeuge und können teilweise Mengen unterscheiden. Sie erleiden aber auch Schmerzen und Stress. Bereits in den 80er Jahren wurde schon zweifelsfrei belegt, dass Fische leidensfähig sind. Dies wurde in den 90er Jahren auch gerichtlich bestätigt (OLG Celle, AZ 23 Ss 50/97). Sowohl die Europäische Kommission als auch die EFSA bestätigten 2009, dass die Reaktionen bestimmter Fischarten in bestimmten Situationen annehmen lässt, dass sie auch in der Lage sind, Angst zu empfinden. Auf Grundlage naturwissenschaftlicher Untersuchungen zu Fischen kommt Markus Wild, Prof. für theoretische Philosophie an der Universität Basel, in einem Gutachten zum Schmerzempfinden bei Fischen zu dem Ergebnis, dass sich Fische nicht so sehr von Säugetieren unterscheiden. Auch wenn sie es nicht deutlich zeigen können: Fische leiden unter Schmerzen und unter Stress. Aber – anders als bei Säugetieren – können Fische ihren Schmerz nicht artikulieren. Deshalb sah man Fische lange Zeit nur als reine Reflexmaschinen, die man eher als Masse oder Schwarm wahrnahm.
Beispiele für Tierversuche mit Fischen
Diabetes-Versuche mit Zebrafischen
Dem kleinen Zebrafisch wird seine ungewöhnliche Fähigkeit zur Regeneration zum Verhängnis: Da er in der Lage ist, seine Rückflosse nach Verletzungen neu zu bilden, wird er in Versuchen zur Zuckerkrankheit (Diabetes mellitus Typ 1) eingesetzt. Dazu wird zunächst künstlich ein Diabetes beim Fisch erzeugt, indem mit einer giftigen Lösung die insulinproduzierenden Zellen seiner Bauchspeicheldrüse zerstört werden. Erst dann beginnt der eigentliche Versuch, bei dem dem Fisch die Rückenflosse amputiert wird. Dies dient dazu, um zu untersuchen, ob der künstlich erzeugte Diabetes die Fähigkeit zur Regeneration beeinträchtigt. Am Ende der Versuche werden die Tiere getötet. Auch Zebrabärblinge verfügen über ein beachtliches Regenerationsvermögen. Sie können sogar eine Verletzung am Herzen regenerieren. Um diese Erkenntnisse zu gewinnen, wurden verschiedene gentechnisch veränderte Fischlinien mit einem in flüssigem Stickstoff gefrorenen Kupferfaden am Herzen so verletzt, dass Gewebe abstarb. Bei einem ähnlichen Versuch wurden transgene Fische teilweise mehreren Hitzeschock ausgesetzt, um eine Reaktion des Gewebes zu bewirken. Nach den Versuchen werden die Tiere getötet.
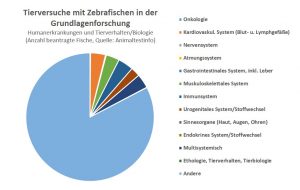
Fluoreszierende Zebrafische zur Erforschung von Gefäßschäden
Bei Patienten mit Diabetes mellitus entsteht das sogenannte Methylglyoxal als Nebenprodukt von Stoffwechselvorgängen. Um die Wirkweise dieser Zuckerablagerungen besser zu verstehen, werden Zebrafischembryonen eingesetzt, bei denen künstlich Gefäßschäden durch hohe Glucose und Methylglyoxal-Konzentrationen erzeugt werden. Für diese Untersuchung werden die Fische zuvor so gentechnisch verändert, dass sie in der Lage sind, ein Fluoreszenzprotein zu produzieren, das mit einem speziellen Lichtmikroskop erkennbar wird. Damit werden die Fehlbildungen bei der Gefäßentwicklung durch Ablagerungen am lebenden Organismus beobachtet. Ein weiteres Beispiel sind künstlich erzeugte Herzmuskelerkrankungen bei Zebrabärblingen, um die genetischen Mechanismen angeborener Herzerkrankungen des Menschen zu untersuchen. Dazu werden die Erkrankungen künstlich beim Tier nachgestellt. Die Forscher beobachten mit Hilfe von Fluoreszenztechniken dann die Entwicklung der Erkrankung am lebenden Tier.
Fische sterben in akuten Giftigkeitstests
Auch in der regulatorischen Toxikologie, d.h. bei gesetzlichen vorgeschriebenen Giftigkeits-prüfungen, werden Fische eingesetzt. In der Ökotoxikologie sind Fische immer noch wesentlicher Bestandteil der Prüfszenarien. Um beispielsweise das toxische Potential von chemischen Ausgangsstoffen, Fertig- und Zwischenprodukten, Pestiziden, Bioziden, Nahrungsmittelzusatz-stoffen oder Duftstoffen zu untersuchen, wird z. B. der akute Giftigkeitstest durchgeführt. Vor dem Versuch erfolgt eine sogenannte Dosisfindungsstudie, um die Test-Konzentrationen auswählen zu können. Dazu wird dem Wasser solange eine Prüfsubstanz zugessetzt, bis die Hälfte der Fische stirbt. Auch die überlebenden Tiere werden nach dem Versuch getötet.
Leidensreduzierung: Fischembryos statt ausgewachsene Fische
Es gibt mittlerweile mehrere Verfahren, die ohne ausgewachsene Fische auskommen: Dies sind der Fischembryo-Toxizitätstest (FET) (OECD Testrichtlinie 236), der kurzfristige Giftigkeitstest am Embryo und Dottersackstadien (OECD 212), der Early Life Stage-Test mit Fischlarven (OECD 210) und der sogenannte „Fischeitest“ (DIN 2001), bei dem statt ausgewachsenen Fischen die frisch befruchteten Eier des Zebrabärblings (Danio rerio) in der Abwasseruntersuchung eingesetzt werden. Da Larven gegenüber Chemikalien sehr empfindlich sind, gelten diese Tests als gut geeignet zur Vorhersage des gesamten Lebenszyklus. Die Giftigkeit wird anhand der Schädigung des Embryos gemessen, sowie der Schlüpfrate, der Serblichkeit sowie anhand von Wachstum und Deformationen. Diese Ersatzmethoden zum ausgewachsenen Fisch werden in der Fachwelt begrüßt. Doch sie bergen ein moralisches Dilemma: Unter tierethischen Gesichtspunkten ist diese Methode nicht wirklich tierversuchsfrei, weil hier noch immer ein lebendes Tier eingesetzt wird. Dennoch tragen sie zur Leidensreduzierung bei, da man davon ausgeht, dass die Entwicklungsstadien wahrscheinlich keine oder weniger Schmerzen erleiden als ausgewachsene Fische.
Fische in Langzeit-Giftigkeitstests
Fische kommen auch im Bereich der Langzeit-Giftigkeitstests (Langzeittoxizität) zum Einsatz. Zum Beispiel beim sogenannten „Extended One Generation Reproduction Test“ (OECD Testrichtlinie 240). Dabei werden Reiskärpflinge (Medaka) über mehrere Generationen einer Substanz ausgesetzt und die Effekte einer Chemikalie auf mehrere Generationen untersucht. Alle Tiere werden nach dem Versuch getötet und untersucht. Ein weiteres Beispiel ist der „Juvenile Growth Test“ (OECD 215). Dieser Langzeit-Giftigkeitstest dauert 28 Tage. Hier werden Regenbogenforellen (Oncorhynchus mykiss) über einen längeren Zeitraum einer potenziell giftigen Substanz ausgesetzt. Danach wird die Auswirkung der Chemikalie auf das Wachstum der Jungfische untersucht. Für diesen Test gibt es noch kein anerkanntes tierversuchsfreies Verfahren.

Lichtblicke: Giftigkeitsprüfungen an Zelllinien
Verschiedene Wissenschaftlerteams haben in den letzten Jahrzehnten versucht, den akuten Fischtest (OECD 203) durch Fischzelllinien zu ersetzen. Ein neues Verfahren ist das des Schweizer Wasserforschungsinstituts EAWAG, das auf Basis von Kiemenzellen arbeitet und vergleichbar mit Fischembryotest ist. Neben der Kiemenzelllinie nutzen die Schweizer Wissenschaftler auch Leberzellen und Darmzellen der Regenbogenforelle. Grundsätzlich empfehlen die Forscher Kombination aus verschiedenen Tests. Weitere Verfahren auf Basis von Zelllinien basieren beispielsweise auf Epithelzellen der Elritze, dem Keimdrüsengewebe der Regenbogenforelle oder dem Bindegewebe des Goldfisches.
EU fordert Nutzung mehrerer Ansätze
Die europäische Validierungsbehörde ECVAM, die für die Anerkennung neuer Verfahren als Ersatzverfahren zum Tierversuch zuständig ist, hat in ihrem Statusbericht für 2015 drei tierversuchsfreie Verfahren zu Giftigkeitstests an Fischen beurteilt und hat einen Strategieplan vorgelegt, wie die Tierversuche minimiert oder vermieden werden können. Darunter fiel ein Test auf zellschädigende Wirkung auf Basis einer Kiemenzelllinie der Regenbogenforelle und sogenannte „Adverse Outcome Pathways“ (AOPs) für den Bereich der Langzeitgiftigkeitstests an Fischen. Unter AOPs versteht man Untersuchungen, über welche Wege und Mechanismen Chemikalien den Körper negativ beeinträchtigen können. Dazu betrachtet man den schädigenden Einfluss beginnend mit der molekularen Ebene, über die Zellebene, das Organ, den gesamten Organismus bis hin zu einer ganzen Population. Ziel ist es eine Toolbox mit relevanten AOPs und dazu passende, auf dem Embryonenfischtest basierende, Testreihen zu entwickeln. Ein weiteres Verfahren, das als „Treshold of toxicological Concern“ (TTC) bezeichnet wird, zielt darauf ab, das Expositionsniveau aller Chemikalien bestimmen zu können, unter dem kein spürbarer schädigender Effekt auftritt. Das Konzept, das bereits bei der Risikobewertung von Chemikalien eingesetzt wird, kann helfen, Giftigkeitstests mit Fischen zu vermeiden. Unter Berücksichtigung des gegenwärtigen Stands der Technik schlägt die Validierungsbehörde vor, dass u.a. zur Identifizierung und Klassifizierung der akuten und chronischen Fischtoxizität eine Vielzahl an Ansätzen genutzt werden sollte, um den Tierversuch zu minimieren oder besser zu vermeiden. Dazu sollen mehrere OECD-Testrichtlinien überarbeitet bzw. überprüft werden. Außerdem sollen die Einsatzmöglichkeiten von Zelllinientests untersucht und validiert werden und u.a. der Zebrafisch Embryotoxizitätstest, der TTC-Ansatz sowie die Anwendung des AOP-Konzepts vorangetrieben werden.
Ferne Zukunftsvision: Fish-on-a-Chip

Ein Lösungsansatz könnte analog zum Human-on-a-chip der Fish-on-a-Chip sein. Doch eine Kombination einzelner Fischorgane in Miniaturform auf einem Chip gibt es noch nicht. Schweizer Wissenschaftler haben jedoch einen Anfang gemacht: Mit einem Organ-on-a-Chip mit Fischdarmzellen werden Expositions- und Transportphänomene untersucht sowie physiologische Stressfaktoren und das Zusammenspiel verschiedener Zelltypen. Die in-vitro-Zellmethoden sind aber derzeit noch nicht validiert. 2014 stellten zudem chinesische Wissenschaftler einen Zebrafish on-a-Chip für Giftigkeitstests und Untersuchungen von fruchtschädigenden Effekten vor. Der grundsätzliche Ersatz von Tierversuchen durch Chips im Hochdurchsatzverfahren liegt im Bereich der aquatischen Toxikologie jedoch noch in weiter Ferne.
Softwareprogramme ergänzen Zelltests
Es gibt einige frei verfügbare Softwareprogramme, um die Eigenschaften von Chemikalien zu beurteilen. Mit ihnen lässt sich eine mögliche Giftigkeitswirkung im Wasser vorhersagen. Diese Vorhersagemodelle reichen zwar alleine nicht aus, doch sie können den FET und die in-vitro-Zelltests ergänzen.
Humane Krankheitsmodelle statt genmanipulierte Fische
Anstelle von Tiermodellen können heute auch humane Krankheitsmodelle in der Petrischale erzeugt werden. Wie bei den gentechnischen Veränderungen beim Tier kann dafür ebenfalls die CrispR/Cas9-Methode genutzt werden. Das wichtigste Ziel von in-vitro-Krankheitsmodellen ist es, ein tieferes Verständnis in die Krankheitsursachen zu gewinnen, um neue oder verbesserte Therapien zu entwickeln. Es gibt mittlerweile unzählige Krankheitsmodelle in der Petrischale für die Organe Herz, Lunge, Darm, Leber und Nieren. Weitere Modelle eignen sich für die Untersuchung der Blutbildung, der Gefäße, des Hormonhaushaltes, des Skeletts und des Nervensystems. Hinzu kommen Knorpelerkrankungsmodelle, Hauterkrankungsmodelle und Modelle der verschiedensten Infektions- und Krebserkrankungen.
Ausblick: Nötig sind Investitionen und Kombinationsverfahren
Beim Fisch wird der kontinuierliche Anstieg der Tierverbrauchszahlen im Bereich der gentechnischen Veränderung besonders deutlich. Dies zeigt – nicht nur für den Fisch – die Dringlichkeit eines Verbotes von Patenten auf Tiere sowie den Schutz der genetischen Integrität von Lebewesen. Dabei bieten humane Krankheitsmodelle ein großes Potential, um Krankheiten des Menschen zu untersuchen. Die Zukunft in der Grundlagenforschung muss deswegen heißen: Menschliche Krankheitsmodelle statt genmanipulierte Tiere.
Betreffend des Entwicklungsstandes der tierversuchsfreien Methoden lässt sich sagen, dass bereits diverse Bausteine an Verfahren zur Verfügung stehen. Bewährt hat sich zweifelsfrei der Fischembryotest. Laufende Untersuchungen bestätigen seine Aussagefähigkeit insbesondere als Alternative für den akuten Fischtest. Zudem ist die Industrie an dem vergleichsweise kostengünstigen Embryotest interessiert, was dem Verfahren weiteren Auftrieb geben wird. Doch der Test an Embryonen birgt ein moralisches Dilemma: Unter tierethischen Gesichtspunkten ist diese Methode nicht wirklich tierversuchsfrei, weil hier noch immer lebende Tiere eingesetzt werden. Fest steht jedoch, dass er zur Leidensreduzierung beiträgt, solange es noch keine anderen Verfahren gibt.

Ein vielversprechender Bereich sind Zelllinientests, wie beispielsweise das Verfahren des Schweizer Wasser-forschungsinstituts EAWAG, das auf Basis von Kiemenzellen arbeitet. Aus tierethischer Sicht sind diese Verfahren auch teilweise problematisch, da für die Gewinnung der Zellen auch Tiere sterben müssen.
Aber sie tragen zu einer erheblichen Leidensreduzierung bei, da nicht mehr am lebenden Tier getestet wird. Deswegen ist zu hoffen, dass die derzeit laufende internationale Ringstudie positive Ergebnisse bringt und die Methoden möglichst schnell behördlich anerkannt werden.
Das größte Potenzial zur Ablösung der qualvollen Fischtests liegt in der Kombination verschiedener Methoden. Insofern ist die Strategie der EU-Zulassungsbehörde ECVAM zielführend, die auf eine Verknüpfung unterschiedlicher Verfahren setzt. Vielversprechend sind u.a. Zelllinientests, der Fischembryotest, die „Adverse Outcome Pathway“ (AOPs) für den Bereich der Langzeit-giftigkeitstests an Fischen und das Konzept des „Treshold of Toxicological Concern“. Damit die Kombinationen verschiedener Verfahren in der Praxis ankommen und zur Ablösung des Tierversuchs beitragen, fordert der Bundesverband, die Validierung und Anerkennung von sogenannten integrierten Teststrategien und ggfs. damit verbundener Messgeräte, wenn einzelne Methoden als Ersatz zum Tierversuch nicht ausreichen. Eine weitere wichtige Maßnahme ist die Streichung der Tierversuchsverfahren aus den Prüfvorschriften, sobald ein tierversuchsfreies Verfahren aufgenommen wird und die zwingende Anwendung dieser Methode.
Mehr Forschungsförderung
Um die Entwicklung neuer sowie den Ausbau und Kombination vorhandener tierversuchsfreier Methoden zu beschleunigen, muss jedoch noch erhebliche Forschungsarbeit geleistet werden. Dazu muss deutlich mehr Forschungsförderung in die Entwicklung dieser Verfahren fließen. Darüber hinaus ist die Etablierung weiterer Lehrstühle für tierversuchsfreie Methoden, ein Ausbau der Förderung von Nachwuchswissenschaftlern, die Unterstützung potenzieller Methoden bis zu ihrer Anerkennung sowie schnelle Anerkennungsverfahren auf europäischer und internationaler Ebene notwendig. Denn die behördlichen Anerkennungsverfahren dauern mit 6 bis15 Jahren immer noch viel zu lang. Weitere zielführende Maßnahmen für einen Paradigmenwechsel hin zu einer tierversuchsfreien Zukunft hat der Bundesverband in einem umfangreichen Maßnahmenkatalog zusammengestellt.
Hier lesen Sie die am häufigsten gestellten Fragen zum Versuchstier des Jahres 2016.
 Weitere ausführliche Informationen zum Versuchstier des Jahres 2016 lesen Sie in unserer Broschüre, die Ihnen wir als PDF (22 Seiten, 680 kb) zum Herunterladen anbieten.
Weitere ausführliche Informationen zum Versuchstier des Jahres 2016 lesen Sie in unserer Broschüre, die Ihnen wir als PDF (22 Seiten, 680 kb) zum Herunterladen anbieten.
 Der Bundesverband dankt der engagierten Autorin und Tierrechtlerin Hilal Sezgin, die die diesjährige Schirmherrschaft für das „Versuchstier des Jahres“ übernommen hat. Hier lesen Sie ihr Grußwort.
Der Bundesverband dankt der engagierten Autorin und Tierrechtlerin Hilal Sezgin, die die diesjährige Schirmherrschaft für das „Versuchstier des Jahres“ übernommen hat. Hier lesen Sie ihr Grußwort.